1. Bảng tuần hoàn hóa học là gì?
Bảng tuần hoàn hóa học hay còn được gọi là bảng tuần hoàn Mendeleev, là phương pháp dạng bảng hiển thị lên các nguyên tố hóa học phát minh vào năm 1869 do nhà hóa học Dimitri Mendeleev người Nga.
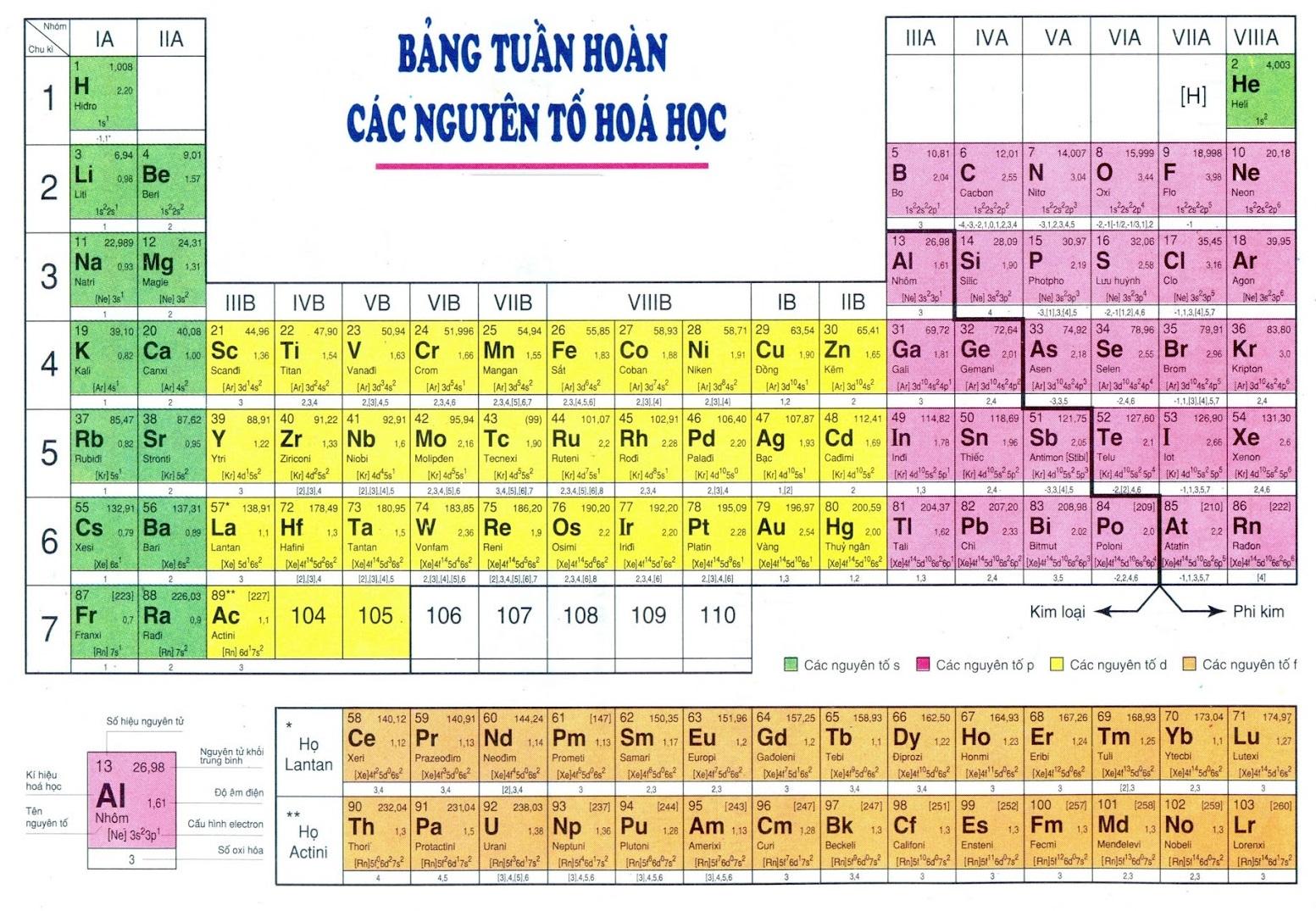
Bảng tuần hoàn hóa học biểu thị nguyên tố hóa học theo cách sắp xếp số hiệu nguyên tử của nguyên tố, cấu hình electron và quy luật tuần hoàn khác. Giá trị của bảng tuần hoàn hóa học là có thể tính toán tính chất hóa học của một nguyên tố dựa trên vị trí của nó.
Bảng tuần hoàn hóa học đầy đủ nhất sẽ được tổng hợp cho các bạn học sinh nắm rõ. Vì vậy hãy theo dõi thật kỹ nhé!
2. Cấu tạo của bảng tuần hoàn
2.1. Ô nguyên tố
Ô nguyên tố biểu hiện ra cho chúng ta biết các số hiệu nguyên tử, tên nguyên tố, ký hiệu hóa học, nguyên tử khối của nguyên tố đó. Số hiệu nguyên tử có số trị bằng số đơn vị của điện tích hạt nhân và bằng số electron trong nguyên tử. Số hiệu nguyên tử là số thứ tự của nguyên tố đó ở trong bảng tuần hoàn.
Ví dụ: Số hiệu nguyên tử của Magie là 12 cho biết rằng số đơn vị điện tích hạt nhân là 12, Magie ở ô số 12, có 12 electron trong nguyên tử Magie.
2.2. Chu kỳ
Chu kỳ được hiểu là dãy các nguyên tố mà nguyên tử của chúng được xếp theo chiều điện tích hạt nhân tăng dần và có cùng số lớp electron.
Số lớp electron = STT của chu kỳ.
Bảng tuần hoàn hóa học gồm có 7 chu kỳ, trong đó có các chu kỳ nhỏ là chu kỳ 1, 2, 3, các chu kỳ lớn là 4, 5, 6, 7.
-
Chu kỳ 1: Có 2 nguyên tố là He và H, có 1 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ H 1+ tới He 2+.
-
Chu kỳ 2: 8 nguyên tố từ Li đến Ne, có 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ Li 3+ tới Ne là 10+.
-
Chu kỳ 3: Gồm 8 nguyên tố từ nguyên tố Na đến Ar, có 3 lớp electron trong nguyên tử và điện tích hạt nhân tăng từ Na 11+ đến nguyên tố Ar là 18+.
-
Chu kỳ 4, chu kỳ 5: Với cả 2 chu kỳ, mỗi chu kỳ đều có 18 nguyên tố, bắt đầu là kim loại kiềm K là 19+ và Rb là 37+, kết thúc là một khí hiếm Xe là 54+ và Kr là 36+.
-
Chu kỳ 6: Bắt đầu từ kim loại kiềm Cs là 55+ và kết thúc là khí hiếm Rn là 86+. Có 32 nguyên tố,
-
Chu kỳ 7: Chưa được hoàn thành.
Đăng ký ngay khóa học DUO 11 để được lên lộ trình ôn thi tốt nghiệp sớm nhất!

2.3. Nhóm nguyên tố
Vậy bảng tuần hoàn hóa học có bao nhiêu nguyên tố? Và được chia thành các nhóm thế nào?
Bảng tuần hoàn hóa học có 118 nguyên tố, gồm các nguyên tố từ 1 (Hidro) đến 118 (Oganesson). Nhóm các nguyên tố mà nguyên tử có số electron lớp ngoài cùng bằng nhau và do có tính chất tương tự nhau được xếp theo chiều tăng của điện tích hạt nhân nguyên tử.
Số thứ tự của nhóm nguyên tố bằng số electron lớp ngoài cùng của nguyên tử.
Ta chia thành 2 loại nhóm nguyên tố là nhóm nguyên tố A và nhóm B:
-
Nhóm A: Gồm các nguyên tố p và s. Số nhóm A bằng tổng số electron lớp ngoài cùng.
-
Nhóm B: Gồm các nguyên tố f và d có cấu hình electron nguyên tử thì tận cùng sẽ ở dạng (n-1) dxnsy
+ Nếu (x+y) = 3 -> 7 thì nguyên tố đang xét thuộc nhóm (x+y)B.
+ Nguyên tố thuộc nhóm VIIIB nếu (x+y) = 8 -> 10.
+ Nguyên tố thuộc nhóm (x+y-10)B nếu (x+y) > 10 thì
3. Ý nghĩa bảng tuần hoàn hóa học
Dựa vào bảng tuần hoàn hóa học, ta có thể biết vị trí của nguyên tố và suy đoán ra tính chất của nguyên tố và cấu tạo nguyên tử.
Ví dụ: Nguyên tố A với số hiệu nguyên tử 17, thuộc nhóm VIIA, trong chu kì 3.
Nguyên tố A có số hiệu nguyên tử là 17, nên điện tích hạt nhân của nguyên tử A là 17+, nguyên tử A có 17 electron.
Nguyên tố A nhóm VIIA nên có thể suy ra lớp ngoài cùng có 7e, ở chu kì 3 nên nguyên tử A có 3 lớp electron.
Tính phi kim của nguyên tố A yếu hơn nguyên tố phía trên nó cùng nhóm (nguyên tố F có số hiệu nguyên tử 9), mạnh hơn nguyên tố trước nó trong cùng 1 chu kì (S có số hiệu 16) và nguyên tố đứng dưới nó trong cùng nhóm (Br có số hiệu nguyên tử 35). Vì ở vị trí gần cuối chu kì 3 nên nguyên tố A là một phi kim mạnh.
Bảng tuần hoàn hóa học giúp chúng ta biết cấu tạo nguyên tử của nguyên tố có thể suy ra vị trí và tính chất nguyên tố ấy.
Ví dụ: Nguyên tố Y có điện tích hạt nhân là 11+, lớp ngoài cùng có 1 electron, 3 lớp electron
Vì nguyên tố Y có điện tích hạt nhân là 11+, 3 lớp electron và có 1e ở lớp ngoài cùng, nên nguyên tố Y ở chu kì 3, ô 11, nhóm IA.
→ Nguyên tố Y là kim loại vì nó ở đầu chu kỳ.
4. Bảng tuần hoàn hóa học Mendeleev
Bảng tuần hoàn hóa học đầy đủ còn được biết đến tên gọi là bảng tuần hoàn hóa học Mendeleev.
-
Bảng nguyên tố hóa học lớp 8
Bước vào chương trình Hóa học lớp 8, Bộ giáo dục và đào tạo cho học sinh tiếp xúc với một số vấn đề liên quan đến bảng tuần hoàn. Điều này giúp học sinh có thể làm quen được điều căn bản, hiểu được bản chất của vấn đề. Một số điều mà học sinh sẽ được tiếp cận là:
-
Nguyên tử
-
Nguyên tố hóa học

-
Bảng tuần hoàn hóa học lớp 9:
Với Hóa 9, học sinh sẽ được cái nhìn khái quát về bảng tuần hoàn hóa học. Sơ lược 1 số kiến thức về bảng tuần hoàn hóa học, gồm có:
-
Nguồn gốc
-
Nguyên tắc sắp xếp các nguyên tố
-
Cấu tạo
-
Sự biến đổi tính chất các nguyên tố
-
Ý nghĩa của bảng tuần hoàn

-
Bảng nguyên tố hóa học lớp 10:
Sau khi đã được làm quen với bảng tuần hoàn các nguyên tố hóa học thì khi lên lớp 10, đòi hỏi học sinh phải nắm chắc kiến thức thật chắc. Trong Hóa học 10, bảng tuần hoàn hóa học chủ yếu chỉ đi sâu hơn về: Nguồn gốc về sự phát minh, nguyên tắc sắp xếp các nguyên tố, cấu tạo bảng tuần hoàn, bài luyện tập nâng cao, cơ bản.
5. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Trong bảng tuần hoàn hóa học, các nguyên tố sẽ được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
6. Cách đọc bảng tuần hoàn hóa học
Để học sinh sử dụng bảng tuần hoàn một cách dễ dàng, hãy xem cách đọc bảng tuần hoàn hóa học dưới đây:
+ Số nguyên tử: Còn có tên gọi khác là số proton của nguyên tố hóa học. Đây là số proton tìm thấy trong hạt nhân của 1 nguyên tử. Là số điện tích hạt nhân. Số nguyên tử giúp xác định được duy nhất 1 nguyên tố hóa học.
+ Nguyên tử khối trung bình: Nguyên tử khối của các nguyên tố có đồng vị là số NTK trung bình của hỗn hợp các đồng vị, tính đến tỷ lệ phần trăm số nguyên tử tương ứng.
+ Độ âm điện: Là khả năng hút electron của nguyên tử khi tạo liên kết hóa học. Khi độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim càng mạnh và ngược lại
+ Cấu hình electron: Cho biết phân bố các electron trong lớp vỏ nguyên tử ở trạng thái năng lượng khác nhau.
+ Số oxi hóa: Số oxi hóa là số áp cho một hay nhóm nguyên tử. Nhờ có số oxi hóa mà chúng ta nhận biết được số electron trao đổi khi một chất bị oxi hóa hoặc bị khử.
+ Tên nguyên tố: Là một chất hóa học tinh khiết, gồm 1 kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong hạt nhân.
+ Ký hiệu hóa học: Là tên viết tắt của 1 nguyên tố hóa học trong bảng tuần hoàn hóa học.
7. Cách nhớ bảng tuần hoàn các nguyên tố hóa học
7.1. Ghi nhớ bảng tuần hoàn hóa học bằng cách truyền thống
Nhận biết các thành phần của từng nguyên tố: Khi sử dụng bảng tuần hoàn hóa học, bạn đọc phải biết được số nguyên tử, nguyên tử khối trung bình, cấu hình electron, độ âm điện, số oxi hóa, tên nguyên tố, ký hiệu hóa học. Tất cả đều có trong ô nguyên tố của bảng tuần hoàn.

-
Học vài nguyên tố mỗi ngày: Đây là một cách học được nhiều học sinh áp dụng. Đối với bảng tuần hoàn có rất nhiều nguyên tố khó nhớ và các thông số thì việc phân nhỏ ra để học nó giúp não ghi nhớ được một cách lâu dài.
-
Dán các bảng tuần hoàn hóa học tại nơi dễ nhìn thấy
-
Làm thẻ ghi chú cho mỗi nguyên tố. Cách làm này giống như làm một tập flashcard.
7.2. Dùng phương pháp ghi nhớ bảng tuần hoàn hóa học
7.2.1. Theo dãy hoạt động hóa học của kim loại
Chắc hẳn bạn nào cũng nhớ một câu nói quen thuộc: “Khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu”. Đây là câu nói để ghi nhớ 16 nguyên tố hóa học trong dãy hoạt động hóa học của kim loại. Dãy hoạt động hóa học của kim loại bao gồm: Na, F, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
7.2.2. Theo bài ca hóa trị
Việc ghi nhớ theo bài ca hóa trị cũng là một cách ghi nhớ bảng tuần hoàn hóa học. Các em học sinh có thế tham khảo bài ca hóa trị dưới đây nhé!
Trên đây là toàn bộ những lý thuyết cơ bản cần nắm rõ về bảng tuần hoàn hóa học. Để có thể làm tốt bài tập, các em cần nắm chắc và ghi nhớ bảng tuần hoàn này. Muốn ôn thi đạt được kết quả tốt, các em học sinh có thể truy cập ngay vào nền tảng học online Vuihoc.vn để có thể đăng ký tài khoản hoặc liên hệ nhanh qua trung tâm hỗ trợ của VUIHOC để ôn tập được thật nhiều kiến thức nhé!
