
12/01/2024 22:39
Hoá học 11 Bài 1: Sự điện li
Hoá học 11 Bài 1: Sự điện li
1.1.1. Thí nghiệm
- Trong SGK trình bày cách tiến hành thí nghiệm đồng loạt bằng nguồn điện và hóa chất là NaCl khan, NaOH khan, sacarozơ, nước cất, dd NaCl , dd NaOH , dd sacarozo, ancol etylic.
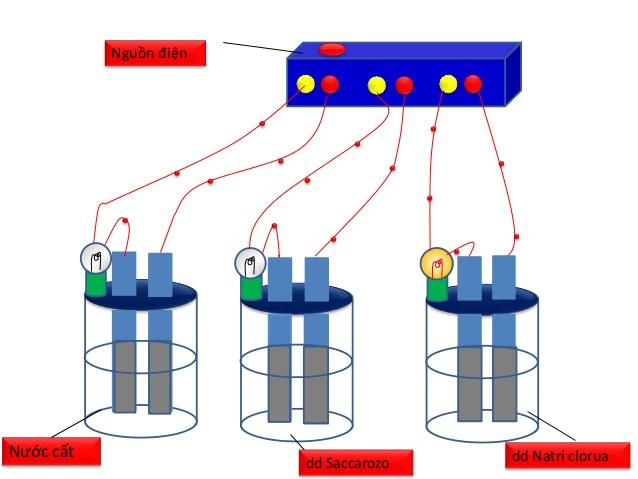
Hình 1: Bộ dụng cụ chứng minh sự dẫn điện của dung dịch
- Tuy nhiên, thí nghiệm này dụng cụ tiến hành thí nghiệm hơi rườm rà nên khi tiến hành cho học sinh quan sát, GV thường sử dụng thiết bị thử tính dẫn điện đơn giản như sau:
Video 1: Thí nghiệm Sự điện li
- Hiện tượng: Dd NaCl, HCl, NaOH, … làm đèn sáng. Dd saccarozơ, rượu etylic … không làm đèn phát sáng
- Giải thích: Cho dụng cụ thử tính dẫn điện vào lần lượt các cốc đựng các chất khác nhau. Bóng đèn phát sáng chứng tỏ chất đựng trong cốc đó có tính dẫn điện.
- Kết luận: Dung dịch Axit, bazơ và muối đều dẫn điện
1.1.2. Nguyên nhân tính dẫn điện của các dd axit, bazơ, muối trong nước.
- Các muối, axít, bazơ khi tan trong nước phân li ra các ion làm cho dd của chúng dẫn điện.
- Quá trình phân li các chất trong H2O ra ion là sự điện li.
- Những chất tan trong H2O phân li thành các ion gọi là chất điện li.
- Sự điện li được biểu diễn bằng pt điện li: NaCl → Na+ + Cl-
HCl → H+ + Cl-
NaOH → Na+ + OH-
1.2.1. Thí nghiệm
- Tiến hành thí nghiệm với chất điện li mạnh như dung dịch NaOH và chất điện li yếu như CH3COOH
Video 2: Tính dẫn điện của dung dịch chất điện li mạnh
Video 3: Tính dẫn điện của dung dịch chất điện li yếu
- Hiện tượng: Cả hai dung dịch đều làm bóng đèn phát sáng. Bóng đèn ở dung dịch axit axetic sáng mờ hơn ở dung dịch NaOH rất nhiều
- Giải thích: ở cùng nồng độ thì NaOH phân li ra ion nhiều hơn CH3COOH. Lượng ion càng nhiều thì tính dẫn điện càng tăng nên bóng đèn ở dung dịch NaOH sáng hơn.
- Nhận xét: Dựa vào mức độ phân li thành ion của các chất điện li khác nhau, người ta chia thành chất điện mạnh và chất điện li yếu.
1.2.2. Chất điện li mạnh, chất điện li yếu
*Chất điện li mạnh:
- Khái niệm: Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion.
- Phương trình điện li NaCl: (chú ý sử dụng mũi tên một chiều)
NaCl → Na+ + Cl-
100 ptử → 100 ion Na+ và 100 ion Cl-
- Bao gồm:
- Các axít mạnh HCl, HNO3, H2SO4…
- Các bazơ mạnh:NaOH, KOH, Ba(OH)2
- Hầu hết các muối.
- Ví dụ: Tính nồng độ của ion Na+ và SO42- trong dung dịch muối Na2SO4 0,1M
Dung dịch muối Na2SO4 là dung dịch chất điện li mạnh nên ta có phương trình ion như sau:
Na2SO4 → 2Na+ + SO42-
0,1M→ 0,2M → 0,1 M
Vậy nồng độ của ion Na+ là 0,2M; của ion SO42- là 0,1M
*Chất điện li yếu:
- Khái niệm: Chất điện li yếu là chất khi tan trong nước, chỉ có 1 phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Phương trình điện li: (chú ý sử dụng 2 mũi tên ngược chiều nhau)
CH3COOH (leftrightarrows) CH3COO- + H+
Ví dụ trong dung dịch CH3COOH cứ 100 phân tử hòa tan thì có 2 phân tử phân li thành ion, 98 phân tử còn lại không phân li.
- Ví dụ:
- Các axít yếu: H2S, HClO, CH3COOH, HF, H2SO3, HNO2, H3PO4, H2CO3, ...
- Bazơ yếu: Mg(OH)2, Bi(OH)3...
- Lưu ý: Quá trình phân li của chất điện li yếu là quá trình cân bằng động, tuân theo nguyên lí Lơ Satơliê.
Link nội dung: https://topnow.edu.vn/bai-1-hoa-11-a65890